Изучение эффективности ингибирования штаммами лактобациллразного вида продукции провоспалительных цитокинов эпителиальными клетками человека Caco-2, индуцированной Campylobacter jejuni
Изучение эффективности ингибирования штаммами лактобациллразного вида продукции провоспалительных цитокинов эпителиальными клетками человека Caco-2, индуцированной Campylobacter jejuni
Аннотация
В результате исследования оценены эффекты влияния лактобактерий на уровни экспрессии провосполительных цитокинов в клетках Caco-2, индуцированных Campylobacter jejuni. Для определения эффективности ингибирования штаммами лактобацилл продукции провоспалительных цитокинов применяли пять видов бактерий рода Lactobacillus: L. crispatus, L. gasseri, L. fermenrum, L. reuteri и L. plantarum. В качестве целевых цитокинов выбраны интрлейкин-1 alfa (Il-1a) и интерлейкин-6 (Il-6). Il-1a синтезируется многими клетками организма и вызывает повышение температуры, а также отвечает за контроль активности лейкоцитов и увеличение количества клеток костного мозга, что может приводить к дегенерации суставов. Интерлейкин 6 является одним наиболее важных медиаторов острой фазы воспаления. Накопление данного цитокина приводит к повышению температуры тела, оказывает стимулирующее действие на синтез белков острой фазы печенью, стимулирует пролиферацию и дифференцировку B- и T-клеток, а также лейкоцитопоэз. Избыточная продукция Il-6 приводит к повреждению тканей вследствие аутоиммунных реакций. В качестве референсного использовали ген домашнего хозяйства hBD-1 (человеческий b-дефенсин). Экспрессия данного белка является конститутивной и не регулируется про воспалительными стимулами или бактериальной инвазией. Совместное инкубирование культуры Caco-2 с C. jejuni и данным микроорганизмом показало снижения экспрессии Il-1a и Il-6 в зараженных клетках до значений, соответствующих контролю. Экспериментально установлено, что при совместном инкубировании клеток Caco-2 с C. jejuni и L. crispatus экспрессия Il-1a снижается в 220 раза по сравнению с контрольными индуцированными C. jejuni клетками, а экспрессия Il-6 снижается в 900 раз. Доказано, что штамм L. fermentum не влияет на уровни экспрессии изучаемых интерлейкинов, а штамм микроорганизма L. reuteri способствует снижению цитокинов до 2000 раз. Показано, что, присутствие L. plantarum приводит к снижению синтеза Il-1a в индуцированной культуре до нормальных уровней, но наиболее эффективной с точки зрения ингибирования провоспалительных цитокинов показал себя штамм L. gasseri.
1. Введение
Продукты промышленного птицеводства относятся к наиболее распространенным в большинстве стран. Эти продукты являются основным источником инфицирования людей кампилобактериями , , . У цыплят, выращенных в условиях промышленного птицеводства, отсутствует колонизационная резистентность кишечника в отношении комменсалов Сampylobacter , , . Эти микроорганизмы вызывают у человека диарею и многочисленные серьезные осложнения. Высокая антигенная изменчивость Сampylobacter снижает эффективность вакцин и свидетельствует о необходимости разработки альтернативных методов борьбы с патогеном , . В качестве альтернативы антибиотикам используются пробиотики , , . В предыдущих наших работах были произведены исследования по отбору перспективных лактобацилл, антагонистичных к Campylobacter jejuni – виду грамотрицательных бактерий, который является наиболее распространенным и более патогенным для человека . Во всем мире кампилобактериозом ежегодно болеют более 400 миллионов человек . В ходе исследования были получены штаммы молочнокислых бактерий – Lactobacillus crispatus ВКМ В-2727Б, L. gasseri ВКМ В-2728Б, L. fermentum ATCC 9338, L. reuteri ATCC 23272, L. plantarum ATCC 8014 и L. plantarum MD IIE-2165 , , , .
Цитокины представляют собой секретируемые или представленные на мембране молекулы, которые определяют широкие клеточные функции, включая развитие, дифференцировку, рост и выживание. Соответственно, регуляция активности цитокинов чрезвычайно важна как физиологически, так и патологически .
Различают провоспалительные и противовоспалительные цитокины (IL-2, IL-10, IL -27, IL -35 и IL -37), а также обладающие двоякими свойствами (например, IL -6). Кроме того, выделяют регуляторные цитокины, которые обеспечивают толерантность к собственным тканям, минимизацию тканевого повреждения. Координированная выработка элементами иммунной системы различных цитокинов происходит в непосредственной близости к клеткам-мишеням , , .
Противовоспалительные цитокины представляют собой серию иммунорегуляторных молекул, которые контролируют провоспалительную цитокиновую реакцию. Цитокины действуют совместно со специфическими ингибиторами цитокинов и растворимыми рецепторами цитокинов, регулируя иммунный ответ. Их физиологическую роль в воспалении и патологическая роль в системных воспалительных состояниях все больше изучают. Основные противовоспалительные цитокины включают антагонист рецептора интерлейкина (IL)-1, IL-4, IL-6, IL-10, IL-11 и IL-13. Специфические цитокиновые рецепторы IL-1, фактора некроза опухоли-α и IL-18 также действуют как ингибиторы провоспалительных цитокинов , .
2. Материалы и методы
Для определения эффективности ингибирования штаммами лактобацилл продукции провоспалительных цитокинов применяли пять видов бактерий рода Lactobacillus: L. crispatus, L. gasseri, L. fermenrum, L. reuteri и L. plantarum. Культивирование лактобактерий осуществляли на классической среде MRS при температуре 25±2оС.
Для культивирования клеточной линии аденокарциномы толстой кишки человека Caco-2 использовали среду DMEM (Sigma -Aldrich, Великобритания) с добавлением 10% фетальной бычьей сыворотки. Культивирование осуществляли в увлажненной атмосфере с добавлением 5% CO2 при 37±2оC. Для проведения эксперимента клетки 20 пассажа при плотности 1x104 клеток/мл высеивали на 24-луночные планшеты для тканевых культур и выращивали до достижения 90% конфлюэнтности.
Культивирование патогенной бактерии Campylobacter jejuni проводили на колумбийском кровяном агаре, содержащем 5% лошадиной крови при 37±2оC в микроаэрофильных условиях.
Инокулумы бактерий получали путем посева 5–10 колоний суточной культуры с чашки Петри в жидкую питательную среду MRS для лактобактерий и бульон Бруцелла для C. jejuni и последующего культивирования при оптимальных температурах до OD 600 равной 0,5.
Для оценки влияния лактобактерий на экспрессию провоспалительных цитокинов в эпителиальных клетках, индуцированных C. jejuni, подготовленные планшеты с клеточной линией Caco-2 инкубировали в течение 5 часов с добавлением 1 мл клеточной культуры C. jejuni, а также ко-культур C. jejuni и лактобактерий при стандартных условиях. По истечении времени инкубирования бактерии удаляли, и клеточный монослой трижды промывали средой DMEM.
Эксперимент проводили в 3 повторностях. Клетки замораживали в жидком азоте и хранили при 80±2оC для последующего выделения РНК и анализа экспрессии. В качестве контроля использовали чистую культуру Caco-2.
Транскрипты целевых генов получали путем выделения тотальной РНК из индуцированных клеток с проведением реакции обратной транскрипцией. Выделение тотальной РНК проводили с помощью коммерческого набора RNeasy Mini Kit (Qiagen. Германия) по протоколу производителя.
Для получения кДНК применяли набор реактивов MMLV RT kit (ООО «Евроген», Россия) с использованием праймера олиго(dT) при синтезе первой цепи. Концентрацию полученной оц-ДНК измеряли с помощью флуориметра Qubit 2.0 (Thermo Fisher Scientific, США). Подбор праймеров к 3’ и 5’ нетранслируемым участков транскриптов осуществляли с помощью программы CLC Genomics Workbench.
Уровни экспрессии транскриптов определяли методом полуколичественной ПЦР в реальном времени с использованием прибора BioRad CFX96 (США). Детекцию накопления продуктов реакции проводили путем добавления в реакционную смесь интеркалирующего красителя SybrGreen. Для амплификации использовали готовую реакционная смесь qPCRmix-HS SYBR (ООО «Евроген», Россия). Амплифицию к ДНК проводили в объеме 20 мкл по протоколу производителя в двух повторностях. Параметры циклирования представлены в таблице 1.
Таблица 1 - Параметры циклирования при амплификации целевых транскриптов
Этап | Стадия | Температура инкубации, оС | Время, сек |
1 | Предварительная денатурация | 98 | 30 |
2 | Денатурация | 98 | 30 |
3 | Отжиг | 57 | 30 |
4 | Элонгация | 72 | 60 |
Снова 2 этап 29 (34) раз | - | - | - |
5 | Финальная элонгация | 72 | 300 |
Для анализа результатов использовали метод относительной оценки экспрессии 2^∆∆Ct, заключающийся в выявлении различий экспрессии в контрольном и экспериментальном образцах. Вычисления осуществлялись в программе CFX Manager.
В результате исследования оценены эффекты влияния лактобактерий на уровни экспрессии провосполительных цитокинов в клетках Caco-2, индуцированных C. jejuni. В качестве целевых цитокинов выбраны интрлейкин-1 alfa (Il-1a) и интерлейкин-6 (Il-6). Il-1a синтезируется многими клетками организма и вызывает повышение температуры, а также отвечает за контроль активности лейкоцитов и увеличение количества клеток костного мозга, что может приводить к дегенерации суставов. Интерлейкин 6 является одним наиболее важных медиаторов острой фазы воспаления. Накопление данного цитокина приводит к повышению температуры тела, оказывает стимулирующее действие на синтез белков острой фазы печенью, стимулирует пролиферацию и дифференцировку B- и T-клеток, а также лейкоцитопоэз. Избыточная продукция Il-6 приводит к повреждению тканей вследствие аутоиммунных реакций. В качестве референсного использовали ген домашнего хозяйства hBD-1 (человеческий b-дефенсин). Экспрессия данного белка является конститутивной и не регулируется про воспалительными стимулами или бактериальной инвазией.
Последовательности праймеров оценки экспрессии данных транскриптов представлены в таблице 2.
Таблица 2 - Последовательности праймеров
Целевой ген | Последовательность |
Il-1a F: | ATG GCC AAA GTT CCA GAC ATG |
R: | TTG GTC TTC ATC TTG GGC AGT CAC |
Il-6 F: | CAT CCT CGA CGG CAT CTC AG |
R: | GCT CTG TTG CCT GGT CCT C |
hBD-1 F: | CTCTGTCAGCTCAGCCTC |
R: | CTTGCAGCACTTGGCCTTCCC |
3. Результаты исследований
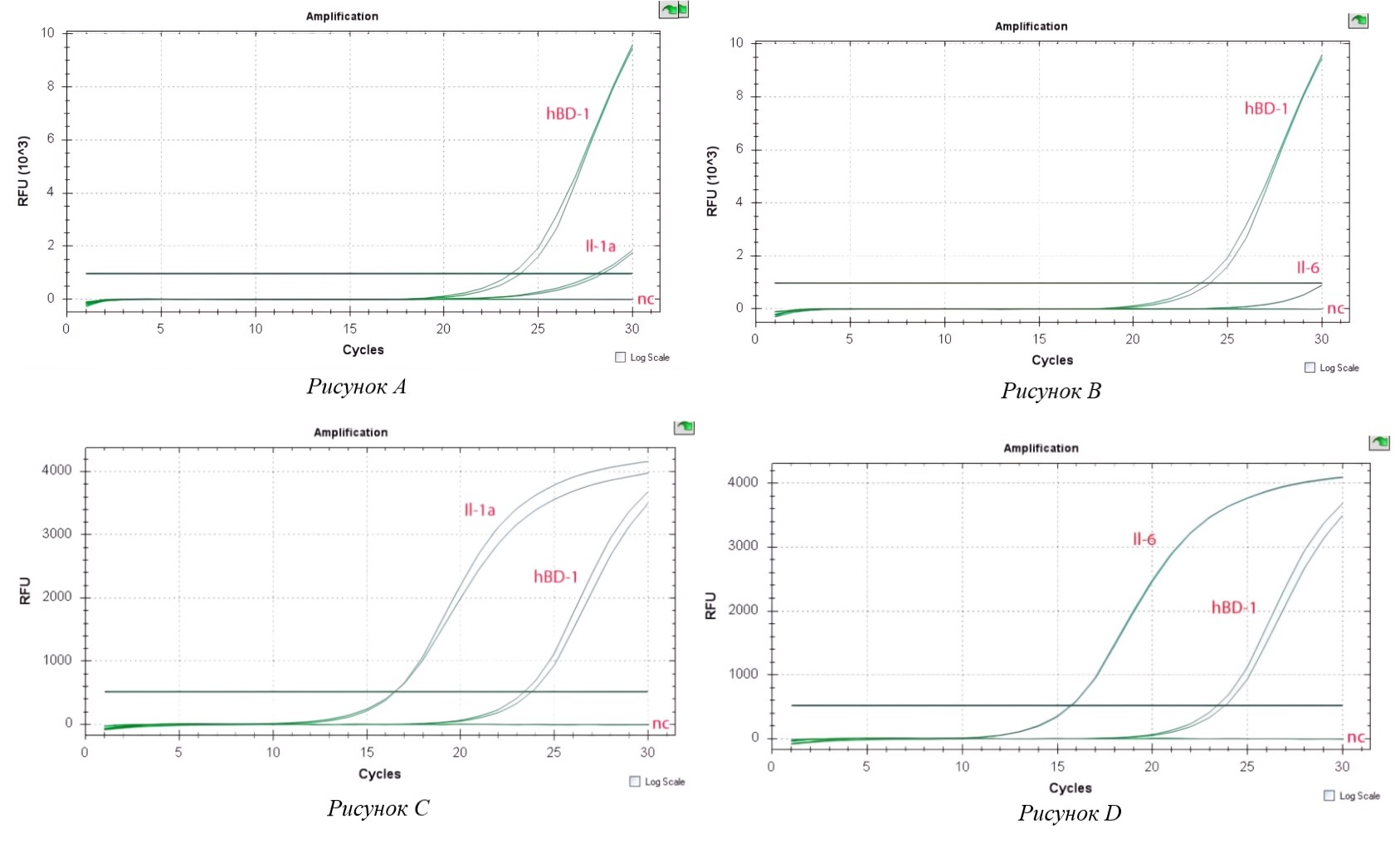
Рисунок 1 - Экспрессия провоспалительного цитокина (А–D)
Примечание: (А) – Экспрессия провоспалительного цитокина Il-1a в контрольных (не индуцированных) клетках Caco-2;
(B) – Экспрессия провоспалительного цитокина Il-6 в контрольных (не индуцированных) клетках Caco-2;
(C) – Экспрессия провоспалительного цитокина Il-1a в клетках Caco-2, индуцированных C. jejuni;
(D) – Экспрессия провоспалительного цитокина Il-6 в клетках Caco-2, индуцированных C. jejuni
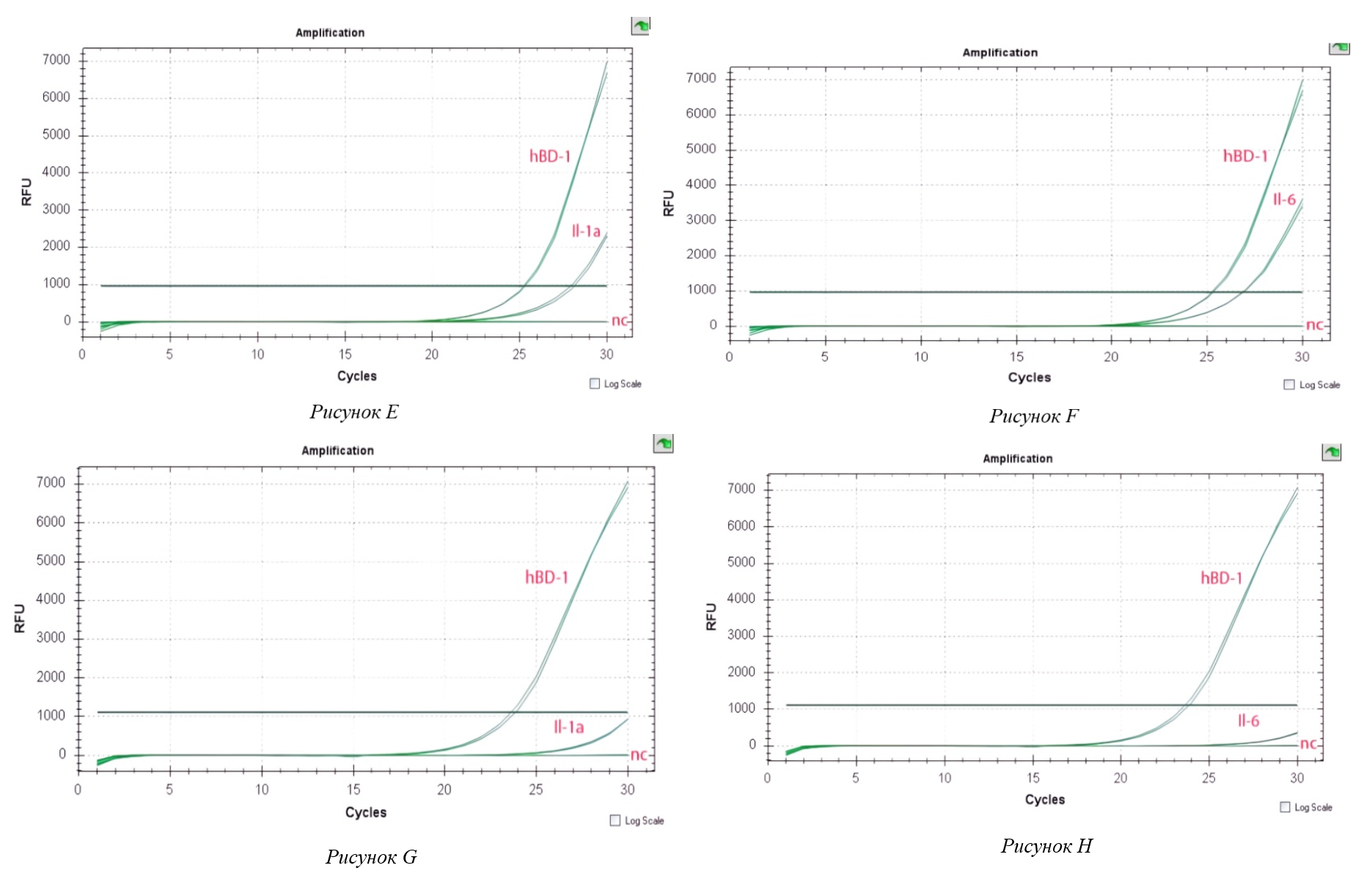
Рисунок 2 - Экспрессия провоспалительного цитокина (E–H)
Примечание: (E) – Экспрессия провоспалительного цитокина Il-1а в клетках Caco-2, индуцированных C. jejuni при совместном инкубировании с L. crispatus;
(F) – Экспрессия провоспалительного цитокина Il-6 в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. crisparus
(G) – Экспрессия провоспалительного цитокина Il-1а в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. gasseri;
(H) – Экспрессия провоспалительного цитокина Il-6 в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. gasseri
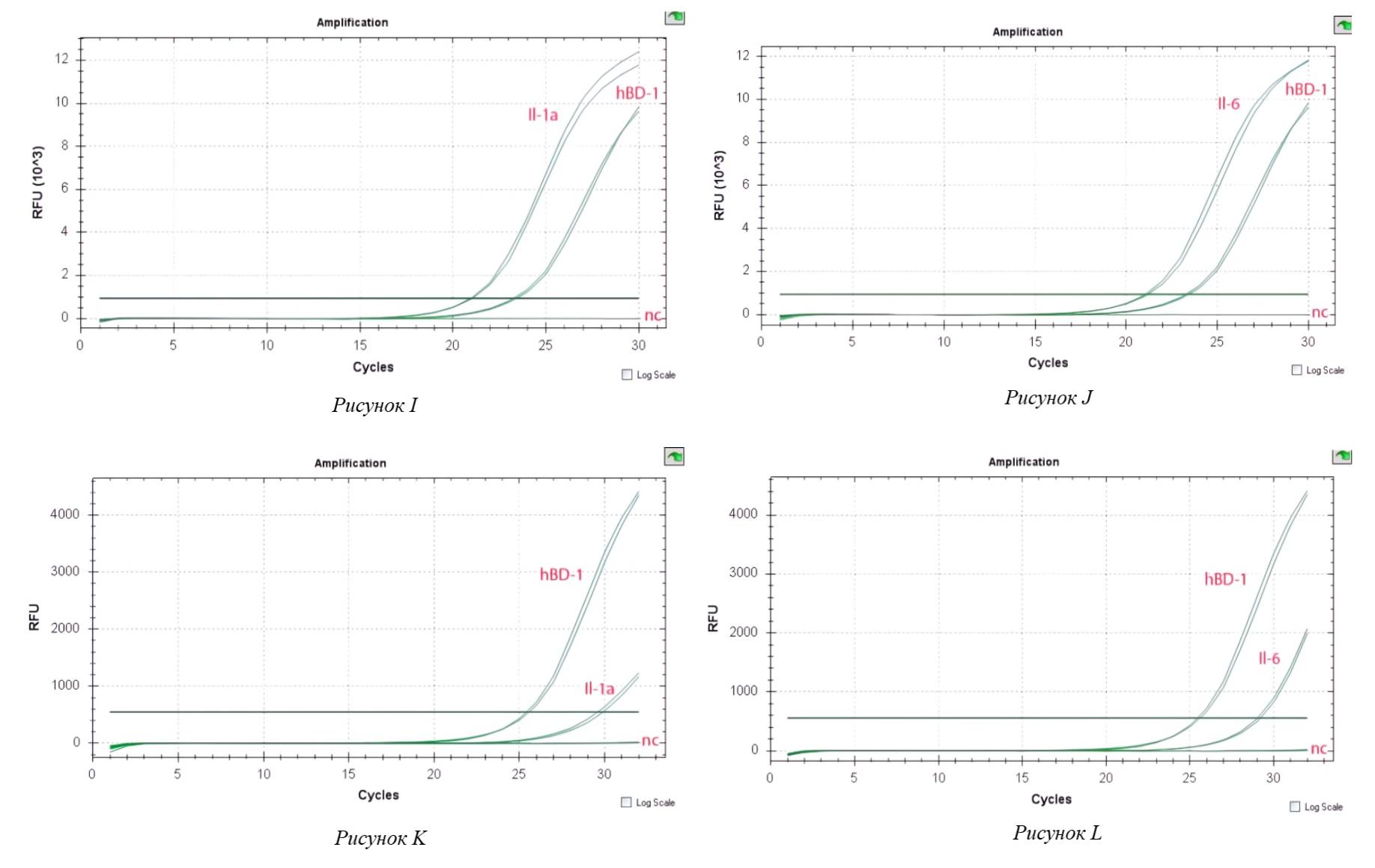
Рисунок 3 - Экспрессия провоспалительного цитокина (I–L)
Примечание: (I) – Экспрессия провоспалительного цитокина Il-1а в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. fermentum;
(J) – Экспрессия провоспалительного цитокина Il-6 в клетках Caco-2, индуцированных C. jejuni при совместном инкуб.с L. fermentum;
(K) – Экспрессия провоспалительного цитокина Il-1a в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. reuteri;
(L) – Экспрессия провоспалительного цитокина Il-6 в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. reuteri
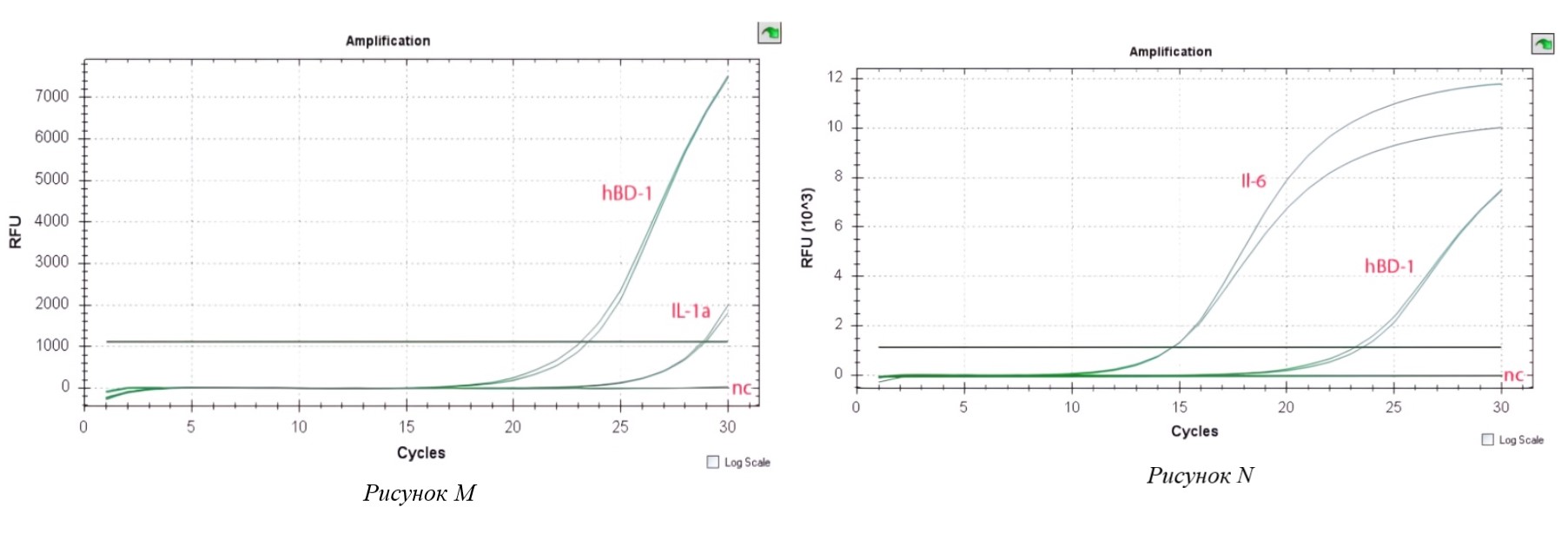
Рисунок 4 - Экспрессия провоспалительного цитокина (M–N)
Примечание: Экспрессия провоспалительного цитокина Il-1a в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. plantarum;
(N) – Экспрессия провоспалительного цитокина Il-6 в клетках Caco-2, индуцированных C. jejuni при совместном инкубировании с L. plantarum
4. Заключение
Таким образом, в ходе проведенного исследования, была изучена эффективность ингибирования штаммами лактобацилл Lactobacillus crispatus, L. gasseri, L. fermentum, L. reuteri, L. plantarum, L.s plantarum продукции провоспалительных цитокинов эпителиальными клетками человека Caco-2, индуцированной С. jejuni. Установлено, что при совместном инкубировании клеток Caco-2 с C. jejuni и L. crispatus экспрессия Il-1a снижается в 220 раза по сравнению с контрольными индуцированными C. jejuni клетками, а экспрессия Il-6 снижается в 900 раз. Доказано, что штамм L. fermentum не влияет на уровни экспрессии изучаемых интерлейкинов, а штамм микроорганизма L. reuteri способствует снижению цитокинов до 2000 раз. Показано, что, присутствие L. plantarum приводит к снижению синтеза Il-1a в индуцированной культуре до нормальных уровней, но наиболее эффективной с точки зрения ингибирования провоспалительных цитокинов показал себя штамм L. gasseri.
